L’article original a été publié dans Le Flyer
Insuffisance rénale chronique : une affection fréquente mais un manque de données pour le choix du meilleur opioïde
Dans l’esprit des cliniciens, insuffisance rénale chronique (IRC) et opioïdes font rarement bon ménage et amènent à une attention toute particulière. L’IRC, il est vrai, est une affection fréquente qui touche près de 3 millions de personnes (soit 10 % de la population) [1], pouvant elle-même être à l’origine de phénomènes douloureux tout en ayant une incidence sur le devenir de la plupart des médicaments antalgiques utilisés en pratique courante.
Cette problématique est particulièrement prégnante en gériatrie où les sujets âgés ont une altération physiologique de leur fonction rénale, s’accentuant au fur et à mesure des années [2]. De même en oncologie, 60 % des patients auraient une altération de la fonction rénale modérée à sévère [1].
La présence de pathologies douloureuses (arthrose, cancer…) implique le besoin d’une prise en charge efficace de la douleur et un recours fréquent aux opioïdes, faibles et forts. Ces derniers pourront voir leurs effets indésirables sensiblement majorés du fait de l’IRC.
Bien que cette interrogation se pose couramment pour le clinicien, le choix de l’opioïde le plus adapté en situation d’insuffisance rénale ne repose que sur de maigres recommandations [3] parfois contradictoires entre elles, essentiellement fondées sur des cas patients. De plus, on retrouve peu d’études comparatives entre les différents opioïdes et une faiblesse des sources établissant un lien clair entre insuffisance rénale, cinétique d’élimination et conséquences cliniques selon l’opioïde envisagé. Avec, de surcroît, des argumentations de firmes pharmaceutiques parfois reprises par des « leaders d’opinion », ne reposant sur aucune donnée scientifique valable, mais qui finissent par devenir des (fausses) vérités [4].
En effet, il n’existe aucune preuve d’innocuité permettant de garantir un usage totalement sûr d’un opioïde par rapport à un autre [5].
Nous avons donc souhaité rédiger un article apportant des précisions à ce sujet, sur la base de la littérature et de l’expérience clinique. Il revient, en première partie, sur une courte définition de l’insuffisance rénale chronique, suivie d’une deuxième partie, passant en revue les différents opioïdes sur la base de leurs propriétés pharmacologiques. Enfin, nous proposons, en guise de conclusion, des axes de réflexion pour aider dans le choix du traitement le plus adapté.
Par souci de simplification, nous nous sommes focalisés sur l’insuffisance rénale chronique, la réalité des situations cliniques rencontrées en pratique courante complexifiant d’autant la prise en charge de la douleur : existence de polypathologies, situations de fragilité spécifiques, autres troubles métaboliques associés… De même, nous ne reviendrons pas ici sur la situation, à part, du patient hémodialysé, qui nécessite une prise en soin spécifique.
Insuffisance rénale chronique : avant tout la définir
La fonction rénale peut être définie par la filtration glomérulaire, le glomérule étant l’unité fonctionnelle du rein. L’insuffisance rénale, en affectant l’élimination de nombreux médicaments, pourra conduire à leur accumulation et à d’éventuels effets indésirables [6]. Dans la plupart des situations, la simple suspicion d’une insuffisance rénale ne sera pas suffisante pour adapter le traitement opioïde. Il faudra préalablement déterminer le niveau d’insuffisance rénale, en se fondant sur une des différentes formules à disposition :
• la formule de Cockroft & Gault, la plus traditionnellement utilisée,
• la formule issue de l’étude MDRD
• ou encore l’équation CKD-EPI, qui a la préférence des sociétés savantes [7].
Toutes ces équations permettent de calculer la clairance, exprimée en ml/min, qui correspond au volume de plasma virtuellement épuré pour une substance donnée. Différents outils en ligne sont disponibles pour effectuer les calculs [8].
Plusieurs stades sont définis selon le résultat obtenu. La gravité de l’IRC pourra s’échelonner du stade I : fonction rénale normale (débit de filtration glomérulaire – DFG > 90 ml/min), au stade V : insuffisance rénale terminale (DFG < 15 ml/min) [5].
Pour un patient donné, la prise en compte du niveau d’IRC (et de ses autres comorbidités…) ainsi qu’une bonne connaissance des propriétés pharmacologiques des différents opioïdes constituent des prérequis indispensables à une utilisation de ces traitements dans les meilleures conditions de sécurité et d’efficacité.
Revue des différents opioïdes
En situation d’insuffisance rénale, le rein ne pourra plus jouer pleinement son rôle d’épuration, avec un effet direct sur l’élimination des médicaments [6] :
• allongement de la demi-vie
• et accumulation potentielle du médicament et de ses métabolites pouvant conduire à une toxicité.
Selon le niveau d’insuffisance rénale, l’opioïde utilisé, sa forme galénique ou d’éventuelles interactions médicamenteuses, les profils de tolérance pourront être extrêmement variables entre individus.
Morphine : prudence en cas d’insuffisance rénale
Molécule la plus étudiée et la mieux connue [6], la morphine présente une demi-vie de 1 à 4 heures. À la différence de la plupart des opioïdes, elle n’est pas métabolisée par les cytochromes, mais par un métabolisme de conjugaison, entraînant la formation de deux métabolites principaux : le M3G, inactif, et le M6G, actif [5, 9].
La morphine, en tant que telle, a une élimination très peu affectée par l’insuffisance rénale, ce qui n’est pas le cas de ses métabolites. Le M6G, en particulier, pourra s’accumuler et être responsable d’effets indésirables majorés : sédations, troubles cognitifs… Néanmoins, il n’existe pas de relation claire avérée entre concentration sanguine en morphine, niveau d’insuffisance rénale et survenue d’effets indésirables. Cette absence de relation linéaire a conduit certains auteurs à se demander « si la morphine n’a pas pire réputation que ce qu’elle mérite » [3].
En pratique, différentes sources évoquent la possibilité d’utiliser la morphine en cas d’IRC [10], à la condition que cette utilisation s’accompagne d’une adaptation progressive de la posologie (le fameux « start low, go slow » – commencer bas et augmenter doucement), dans le cadre d’une surveillance clinique. Dans un document daté de septembre 2016, le NHS (National Health Service – système de santé publique au Royaume-Uni) précise que la morphine semble être un traitement sûr en cas d’insuffisance rénale, si la posologie est augmentée suffisamment progressivement [11]. Dans une enquête menée en France auprès d’anesthésistes-réanimateurs par la Sfar (Société française d’anesthésie-réanimation), en cas d’insuffisance rénale chronique, même sévère, la morphine restait le traitement le plus largement utilisé, des adaptations posologiques devenant plus fréquentes à mesure que l’IRC était marquée [12].
En cas d’insuffisance rénale légère à modérée, ces adaptations pourront aller dans le sens d’une réduction de la posologie, ou d’un espacement des prises (voir tableau). Face à une insuffisance rénale sévère (DFG < 30 ml/min), une forte réduction de la morphine devra être envisagée, voire un recours à un opioïde alternatif [6].
Oxycodone : des métabolites actifs et des précautions analogues à celles de la morphine
Agoniste des récepteurs opioïdes µ et δ, l’oxycodone bénéficie d’une demi-vie de 2 à 3 heures. Son métabolisme est principalement médié par les cytochromes conduisant à la formation d’oxymorphone via le CYP 2D6. Ce métabolite, 14 fois plus actif que l’oxycodone, est éliminé par voie urinaire et pourra s’accumuler en cas d’insuffisance rénale [5, 9].
La mise à disposition en France au début des années 2000 s’est accompagnée de messages la “positionnant” comme une alternative intéressante chez le sujet âgé ou en cas d’insuffisance rénale. Il s’agit plus d’un “positionnement marketing“ visant à élargir son utilisation dans ces conditions plus qu’une position fondée sur des données scientifiques [4]. D’ailleurs, des cas de détresse respiratoire, de sédation profonde et d’effets indésirables majorés chez des patients insuffisants rénaux ont depuis été documentés [3, 13, 14].
Dans une étude comparative récente menée auprès de 180 patients randomisés entre morphine ou oxycodone, les auteurs ont retrouvé les mêmes taux d’effets indésirables quel que soit le traitement reçu par les sujets âgés de plus de 70 ans ou ayant une insuffisance rénale modérée (DFG < 60 ml/min) [15].
En pratique, du fait de l’absence de données d’innocuité pour l’oxycodone en cas d’insuffisance rénale, son utilisation sera conditionnée par les mêmes règles de précautions que la morphine [3, 6] :
• utilisation avec précautions et adaptation progressive de la posologie en cas d’insuffisance rénale légère à modérée
• et forte réduction de la posologie ou recours à un opioïde alternatif en cas d’IRC sévère ou terminale.
Fentanyl : une alternative de choix
Le fentanyl est disponible en France sous différentes formes : transdermique, transmuqueuse, intraveineuse. La demi-vie est de 2 à 4 heures pour la voie intra-veineuse et de 17 heures environ pour les patchs. Le fentanyl est principalement métabolisé par les cytochromes 3A4, aboutissant à la formation de métabolites inactifs [6, 9].
En cas d’IRC, même sévère, ses propriétés pharmacologiques en font une molécule intéressante :
• la demi-vie du fentanyl semble peu influencée par l’IRC ;
• les métabolites ont un risque minimal de s’accumuler et ils ne présentent pas un impact cliniquement significatif.
En cas d’IRC sévère, le fentanyl apparaît comme une molécule de choix, à la condition que les formes galéniques disponibles soient en adéquation avec le profil des douleurs présentées par le patient : douleurs de fond, stables, pour l’usage des patchs par exemple.
Méthadone : des propriétés intéressantes
Métabolisée par les cytochromes, la méthadone présente l’avantage d’être faiblement éliminée par le rein. Ses métabolites sont inactifs (ou considérés comme tels), sans conséquence clinique en cas d’IRC [6].
Tout comme le fentanyl, la méthadone peut être envisagée comme une bonne option en cas d’IRC sévère. Toutefois, sa demi-vie prolongée (24 à 36 heures), sa forte fixation aux protéines plasmatiques et sa très forte variabilité interindividuelle peuvent conduire à des effets imprévisibles, survenant parfois à distance des prises [3].
Ces propriétés semblent réserver la méthadone à des cliniciens expérimentés, aguerris à son utilisation et dans le cadre d’un suivi rapproché. Les autorités de santé positionnent d’ailleurs la méthadone en médicament opioïde de seconde ligne en situation palliative [16].
Buprénorphine :
un agoniste partiel-antagoniste ayant la préférence de certaines équipes
Molécule de haute affinité pour les récepteurs opioïdes, cet agoniste partiel–antagoniste présente une demi-vie courte, comprise entre 2,2 et 3 heures. Tout comme pour la méthadone et le fentanyl, la buprénorphine bénéficie d’un métabolisme purement hépatique avec une élimination majoritairement dans les selles (70 %) ou dans les urines (20 %) [6].
Ses métabolites sont très peu actifs, voire inactifs, sa disponibilité sous forme de comprimés sublingaux ou injectables en font la molécule préférée par certains néphrologues pour la prise en charge des douleurs aiguës ou chroniques chez le patient insuffisant rénal [6].
Le réel inconvénient à la buprénorphine est son effet plafond, qui limite son efficacité au-delà d’un certain seuil. On ne peut pas l’associer à un autre opioïde si cela se révélait nécessaire. En cas d’overdose, elle est difficilement antagonisée par la naloxone.
Par ailleurs, en cas de douleurs résistantes à la molécule, l’effet agoniste partiel–antagoniste et sa longue durée de fixation sur les récepteurs couplée à une forte affinité rendent compliqué le changement vers un autre opioïde du fait d’un “blocage” du système opioïde.
Hydromorphone : disponible uniquement sous forme à libération prolongée
En France, l’hydromorphone n’est disponible que sous sa forme à libération prolongée. La molécule est métabolisée en dérivés conjugués, et son métabolite principal, le H3G, peut s’accumuler en cas d’insuffisance rénale. Certains auteurs ont rapporté un taux d’effets indésirables majorés liés à ce métabolite : myoclonies, convulsions, troubles cognitifs [3]. En pratique, si l’utilisation de l’hydromorphone est envisagée en cas d’IRC, la mise en place du traitement et son adaptation suivront les mêmes règles de précaution que celles de la morphine ou de l’oxycodone [6].
Codéine et tramadol : des opioïdes faibles sujets à de nombreux effets indésirables
L’action analgésique de la codéine s’exerce uniquement après transformation en morphine par les cytochromes au niveau hépatique. La demi-vie de 4 heures peut se prolonger jusqu’à 18 heures chez les patients atteints d’IRC. Outre les effets indésirables de la morphine en situation d’IRC, le métabolisme extrêmement variable de la codéine via le 2D6 rend cette molécule délicate à utiliser et expose à des effets imprévisibles. Du fait d’une balance bénéfices/risques incertaine, il semble préférable d’éviter la codéine en cas d’IRC [9].
Le tramadol agit selon plusieurs mécanismes : sur les récepteurs opioïdes µ et sur les voies monoaminergiques (noradrénaline et sérotonine). La molécule et ses métabolites sont principalement éliminés par voie urinaire, avec une demi-vie de 6 à 8 heures pouvant être multipliée d’un facteur 1,5 à 2 en cas d’IRC. Si le tramadol est utilisé, des ajustements posologiques seront nécessaires, en prenant soin d’éviter les formes à libération prolongée, pouvant majorer les effets indésirables [9].
En pratique, quelles adaptations posologiques ?
Lorsqu’un traitement antalgique doit être mis en place chez un patient atteint d’IRC, l’évaluation du niveau d’insuffisance rénale et la connaissance des propriétés pharmacologiques des différents opioïdes apparaissent comme des préalables indispensables pour un choix éclairé de molécule.
La littérature abonde de classifications fondées sur leur niveau de risque relatif [5, 6, 17] :
• fentanyl, méthadone et buprénorphine apparaissent comme les molécules les plus sûres : elles forment des métabolites principalement inactifs (ou supposés comme tels), ne laissant pas craindre, a priori, d’effet indésirable causé par leur accumulation dans l’organisme ;
• morphine, oxycodone, tramadol et hydromorphone peuvent être utilisés, mais avec précaution : des effets indésirables majorés ont été rapportés lors de leur utilisation chez des patients atteints d’IRC, avec des adaptations posologiques menées en conséquence ;
• la codéine enfin, en raison de ses effets indésirables majorés, associés à un métabolisme imprévisible semble à éviter.
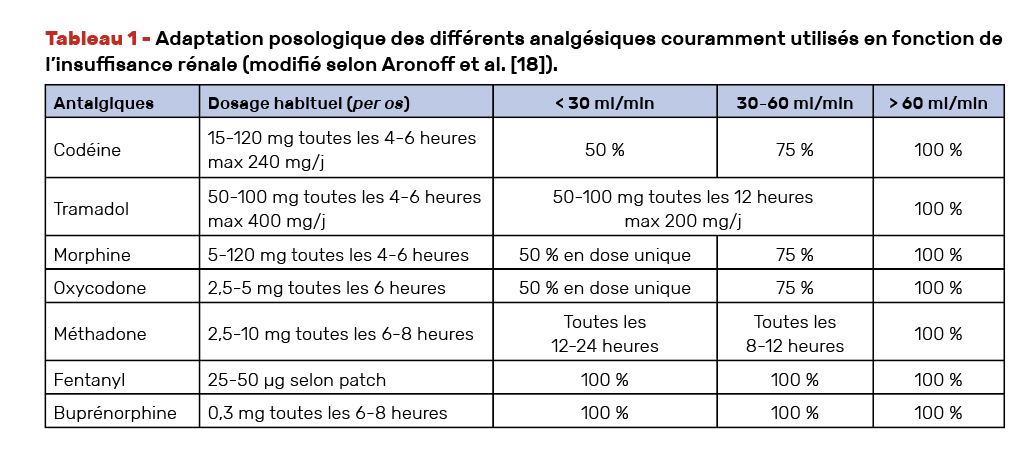
Le tableau ci-dessus, tiré de la Revue médicale Suisse [6], propose des schémas d’adaptation de la posologie selon l’opioïde envisagé et le niveau d’IRC.
En conclusion : le choix de traitement ne se limite pas à l’insuffisance rénale
En effectuant une revue des différents opioïdes sur la base de leurs propriétés pharmacologiques, nous avons regroupé ici, à l’intention des cliniciens, des connaissances utiles pour la pratique clinique.
Toutefois, notre démarche n’est pas dénuée de limites : la littérature est contradictoire, les recommandations sont parfois formulées sur des cas-patients, ou extrapolées en dehors des douleurs cancéreuses.
En cas d’IRC, le « start low, go slow » doit être la règle. Une augmentation très progressive de la posologie et/ou un espacement des intervalles de prise doivent s’accompagner d’une surveillance clinique rapprochée. De même, il semble préférable d’éviter l’utilisation de formes à libération prolongée, qui peuvent augmenter le risque d’accumulation de l’opioïde dans l’organisme.
Enfin, le choix du traitement le plus adapté doit tenir compte du stade d’insuffisance rénale, mais aussi de la situation du patient au sens large.
• Quels ont été les précédents traitements utilisés, leur efficacité et leur tolérance ?
• Existe-t-il d’autres troubles métaboliques (ex : insuffisance hépatique) ou pathologies associées ?
• Quels sont les traitements opioïdes disponibles : molécules, formes galéniques, AMM, modalités de prise, voies de métabolisation… et leurs caractéristiques sont-elles compatibles avec la situation du patient ?
• Quelle est l’expérience du praticien concernant telle ou telle molécule ?
• Existe-t-il d’autres traitements susceptibles d’interagir avec le médicament opioïde ?
• D’autres médicaments associés peuvent-il altérer la fonction rénale (ex : AINS) ?
L’évaluation du traitement et du patient doivent être une préoccupation permanente. Chaque événement est susceptible de justifier une modification de la posologie, à la hausse comme à la baisse.
Bien sûr, tout cela après s’être assuré que la place d’un opioïde (fort ou faible) est justifiée. Pour cela, il est utile de se référer aux récentes recommandations de la Société française d’étude et de traitement de la douleur [19].
Même si la littérature n’est pas riche sur le sujet, il existe néanmoins des données scientifiques qui, une fois colligées, permettent de faire des choix fondés sur de la science plutôt que sur le message de telle ou telle firme. En effet, la forte prévalence de douleurs chez les insuffisants rénaux et sujets âgés (par extension) a contribué à l’émergence de communications laissant penser que telle molécule serait plus efficace et mieux tolérée que telle autre, sans que cela repose sur des données bibliographiques fiables.
Les auteurs ne déclarent pas de lien d’intérêt pour cet article.
Bibliographie
1. Launay-Vacher V, Oudard S, Janus N et al. Prevalence of Renal Insufficiency in cancer patients and implications for anticancer drug management: the renal insufficiency and anticancer medications (IRMA) study. Cancer 2007 ; 110 : 1376–84.
2. Rainfray M, Richard-Harston S, Salles-Montaudon N, Emeriau JP. Les effets du vieillissement sur la fonction rénale et leurs implications en pratique médicale. Presse Med 2000 ; 29 : 1373-8.
3. Sande TA, Laird Barry JA, Fallon MT. The use of opioids in cancer patients with renal impairment —a systematic review. Support Care Cancer 2017 ; 25 : 661.
4. Pouymayou J. Robinet S. Oxycodone : “objet marketing” ou alternative à la morphine. LE FLYER 2016, n° 63.
5. King S, Forbes K, Hanks GW et al. A systematic review of the use of opioid medication for those with moderate to severe cancer pain and renal impairment: A European Palliative Care Research Collaborative opioid guidelines project. Palliative Medicine 2011 ; 25 : 525–52.
6. Bourquin V, Petignat PA, Besson M, Piguet V. Analgésie et insuffisance rénale. Rev Med Suisse 2008 ; 4 : 2218-23.
7. Stevens PE, Levin A, Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Member: Evaluation and management of chronic kidney disease: Synopsis of the kidney disease: Improving global outcomes 2012 clinical practice guideline. Ann Intern Med 2013 ; 158 : 825-30.
8. Société francophone de néphrologie dialyse et transplantation (SFNDT). Calculateurs [en ligne]. Disponible sur [consulté le 26/07/2023] : www.sfndt.org/sn/eservice/calcul/eDFG.htm.
9. Annequin D, Kieffert P, Pouymayou J et al. Opioïdes, métabolisme et métabolites, soyons plus clairs ! Quels sont les risques ? Quelles sont les précautions ? Repères en Gériatrie 2023 ; 25 : 57-61.
10. SiteGPR. Le bon usage clinique du médicament. Recherche par médicament : morphine. [en ligne]. Disponible sur [consulté le 26/07/2023]: www.sitegpr.com/fr/rein/recherche-par-medicaments/.
11. Forrest J. Which opioids can be used in renal impairement. NHS Medicines Q&As 2016.
12. Binhas M, Egbeola-Martial J, Kluger MD et al. Opioids and nonopioids for postoperative pain control in patients with chronic kidney disease. Journal of Opioid Management 2017 ; 13 : 17-25.
13. Foral PA, Ineck JR, Nystrom KK. Oxycodone accumulation in a hemodialysis patient. South Med J 2007 ; 100 : 212-4.
14. Lee MA, Leng ME, Cooper RM. Measurements of plasma oxycodone, noroxycodone and oxymorphone levels in a patient with bilateral nephrectomy who is undergoing haemodialysis. Palliat Med 2005 ; 19 : 259-60.
15. Zecca E, Brunelli C, Bracchi P et al. Comparison of the tolerability profile of controlled release oral morphine and oxycodone for cancer pain treatment. An open label randomized controlled trial. Journal of Pain and Symptom Management 2016 ; 52 : 783-94.e6.
16. AFSSAPS. Douleur rebelle en situation palliative avancée chez l’adulte. Modalités d’utilisation, notamment hors-AMM, de certains médicaments Recommandations de bonne pratique 2010.
17. Johnson SJ. Opioid safety in patients with renal or hepatic dysfunction. Pain Treatments topics 2007.
18. Aronoff GR, Benett WM, Berns JS et al. Drug prescribing in renal failure. American College of Physician 2007.
19. SFETD. Utilisation des opioïdes forts dans la douleur chronique non cancéreuse chez l’adulte [en ligne]. SFETD 2016. Disponible sur [consulté le 26/07/2023] : www.sfetd-douleur.org/wp-content/uploads/2019/06/recos_opioides_forts_sfetd_version_longue.compressed.pdf.