Introduction
En France métropolitaine, une étude épidémiologique collaborative réalisée en 2018 a estimé le nombre de nouveaux cas de maladies néoplasiques à 382 000. Dans cette étude les âges médians au diagnostic et au décès en 2018 sont de 68 et 73 ans chez l’homme et de 67 et 77 ans chez la femme [1]. Ainsi, le cancer représente la première cause de décès en France chez les 65-84 ans. Le nombre de personnes âgées atteintes de cancer, en rémission ou guéries, va croître au cours des prochaines décennies, ce qui s’explique par le vieillissement de la population, le meilleur contrôle des maladies chroniques et la meilleure efficacité en termes de survie de l’arsenal thérapeutique disponible [2]. Une modélisation aux États-Unis estime qu’en 2040, 73 % des patients suivis pour un cancer seront âgés de 65 ans et plus [3].
Si les innovations thérapeutiques issues de la recherche médicale permettent d’espérer de meilleures chances de survie, se pose toutefois la question de l’indication des thérapeutiques médicamenteuses et/ou chirurgicales, des soins oncologiques de support, et parfois de l’abstention thérapeutique (qui n’est pas synonyme d’abstention de soins et/ou de traitements symptomatiques) chez les personnes âgées. Le principal écueil, au cours de ces réflexions, trouve son nom sous le terme d’âgisme, hypothèse selon laquelle la personne âgée est fragile du seul fait de la présence de comorbidités et/ou de vulnérabilités liées au vieillissement [4]. Ainsi, prendre en compte l’âge chronologique, c’est éviter les sur-traitements, c’est-à-dire des effets indésirables plus lourds que ce que le cancer aurait pu générer comme symptômes dans le temps de vie restant. Cependant, si l’âge est à prendre en compte, il ne peut constituer le facteur décisionnel principal. À l’opposé du réductionnisme axé sur l’âge chronologique se trouve la reconnaissance d’une personne singulière, chez qui les décisions sont à considérer de façon individualisée et mesurée [5]. Cette proportionnalité des traitements doit être évaluée à l’aune des personnes, de leurs volontés et de leurs choix, conformément à la loi du 4 mars 2002 [6] dite « loi Kouchner ». C’est ce que s’efforce de traduire le programme personnalisé de soins en formalisant l’accompagnement global du malade tout au long de son parcours en articulant toutes les composantes du programme thérapeutique ; c’est-à-dire la mise en œuvre des traitements anticancéreux et/ou chirurgicaux ainsi que les soins de support [7].
Au cœur du programme personnalisé de soins siège une évaluation globale multidimensionnelle : médicale, fonctionnelle, cognitive, psychologique et sociale. La nutrition tient une place à part dans cette évaluation. En effet, elle est un élément fondamental du projet thérapeutique et médical, car l’altération de l’état nutritionnel (appelée dénutrition) a une incidence négative sur le pronostic de la maladie et majore la toxicité induite par les traitements [8]. Elle est aussi une dimension des soins oncologiques de support (SOS) parce qu’elle influence positivement la qualité de vie relative à la santé des malades et de leurs proches [9]. Pourtant, la dénutrition est encore largement sous-diagnostiquée et sous-traitée dans les pratiques.
Cet article a pour objectif de définir la place à part de la nutrition dans le programme personnalisé de soins des personnes âgées atteintes d’un cancer. Pour ce faire, nous analyserons sa nature hybride, entre la discipline médicale et les SOS, avant de présenter les modalités pratiques d’évaluation, de diagnostic et de prise en charge de la dénutrition.
La nutrition au cœur de la discipline médicale : l’oncogériatrie
Les spécificités et l’hétérogénéité de la population gériatrique demandent une acuité et imposent des compétences particulières. En effet, la situation nutritionnelle d’une personne âgée à un instant donné est la résultante de nombreux facteurs étiologiques eux-mêmes dynamiques et qui nécessitent d’être finement évalués pour une prise en charge globale efficace [10-12]. Ainsi, un bilan étiologique exhaustif a un intérêt central chez la personne âgée. En ces termes, l’oncogériatrie permet cette évaluation afin de garantir à tout patient âgé atteint de cancer un traitement adapté.
Syndrome gériatrique
La prévalence de syndromes gériatriques augmente chez les personnes âgées atteintes de cancer [13]. D’origine multifactorielle, la liste des manifestations cliniques pouvant être associées au syndrome gériatrique ne fait pas l’unanimité, mais elle concerne notamment : les chutes, la présence de comorbidités, l’incontinence, le déclin cognitif et fonctionnel, la dépression et la dénutrition [14]. La fragilité, notion non consensuelle et protéiforme, est considérée par les uns comme appartenant aux signes de syndrome gériatrique, et par les autres comme une conséquence de ce dernier. Le syndrome gériatrique doit donc être évalué et pris en charge, et sinon son risque prévenu et intégré dans la construction du projet thérapeutique.
Évaluation gériatrique approfondie (EGA)
Dans ce contexte, un nouveau type d’évaluation a vu le jour ces dernières années : l’évaluation gériatrique approfondie (EGA). De nature systémique, elle passe au crible les dimensions médicales, fonctionnelles, cognitives, psychologiques et sociales du sujet âgé à l’aide d’outils comme des tests et des échelles validées [15]. Outre l’identification du syndrome gériatrique, elle permet d’évaluer les risques de complications post-opératoires, les toxicités de traitements anti-néoplasiques et la mortalité [16-18]. Si l’état nutritionnel est une dimension du syndrome gériatrique, elle en est aussi une pour l’EGA. L’objectif de l’EGA est donc de guider, sinon de définir, le projet thérapeutique de manière adaptée, ciblée et proportionnée. L’EGA permet ainsi une gradation des prises en charge et des parcours de soins [19]. Une étude française a montré que le statut nutritionnel et fonctionnel de l’EGA contribuait à une modification de traitement du patient [20].
G8 : score d’évaluation pour le recours à l’EGA
Si l’EGA est recommandée par de nombreuses sociétés savantes internationales et européennes, son recours systématique est rendu difficile par le temps qu’elle demande (réalisation de tests, pratique d’un examen clinique, biologie). Face à cette contrainte, des outils ont été développés pour cibler les fragilités et orienter vers une prise en charge spécifique :
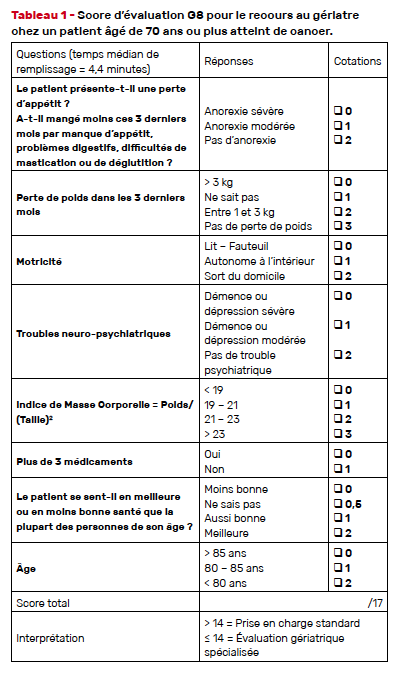
• Le G8 : questionnaire administré par un professionnel et composé de huit items, il est l’outil recommandé en France par l’INCa [21]. Un score inférieur ou égal à 14 indique le recours à une EGA (Tab. 1).
• Le VES-13 : auto-questionnaire comprenant quatre items (âge, santé perçue, difficultés à réaliser six activités spécifiques et difficultés à réaliser les travaux de la vie quotidienne en raison de l’état de santé [22]). Sur une échelle de 0 à 10, un score supérieur ou égal à 3 indique un déficit. Le VES-13 est validé en version française, mais demeure peu utilisé [23].
Ces outils, simples dans leur conception, sont autant accessibles aux professionnels des établissements de soins et médico-sociaux qu’aux professionnels de ville (médecins généralistes, infirmiers et infirmières de pratiques avancées, masseurs kinésithérapeutes, ergothérapeutes ou encore diététiciens). Leurs utilisations devraient être généralisées afin d’évaluer les vulnérabilités et les fragilités pour guider vers une EGA.
La nutrition au cœur des soins oncologiques de support (SOS)
Les soins oncologiques de support sont définis comme « l’ensemble des soins et soutiens nécessaires aux personnes malades tout au long de la maladie conjointement aux traitements oncologiques ou onco-hématologiques spécifiques lorsqu’il y en a [24].»
Définition et objectifs
Leur existence date de plus de 25 ans, favorisée par des dispositions légales et réglementaires dont la circulaire DGOS/INCa de 2017 ayant défini le panier de soins de support. Au-delà des quatre activités du socle de base (soutien social, psychologique, prise en charge nutritionnelle, prise en charge de la douleur) s’ajoutent les activités suivantes :
• activité physique,
• conseils d’hygiène de vie,
• santé sexuelle,
• prise en charge des addictions et des troubles sexuels,
• soutien de la mise en œuvre de la préservation de la fertilité et soutien des proches [25].
Ils ont pour objectif de participer à une approche globale de la personne et d’assurer la meilleure qualité de vie possible pour les personnes malades, sur les plans physique, psychologique et social. Les soins de support proposés et réalisés doivent être tracés a minima dans le programme personnalisé des soins intégré au dossier communicant en cancérologie et le dossier patient.
Ainsi, nous comprenons que les SOS interviennent lors de la mise en œuvre du projet de soins spécifique, après l’EGA. Cependant, le cancérologue ou l’oncogériatre peuvent solliciter les professionnels des SOS afin de faciliter la réalisation de l’EGA ou encore pour prendre en charge de façon urgente d’éventuels déficits et troubles dépistés lors de l’EGA.
Recours aux SOS
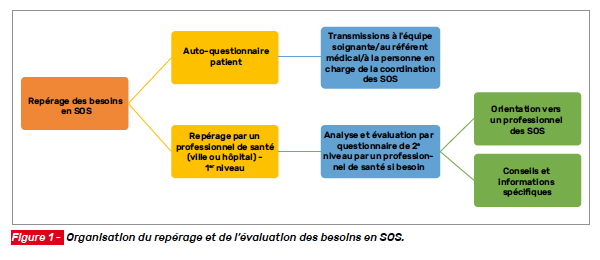
L’enjeu reste celui de pouvoir identifier, dès le diagnostic, les patients ayant des besoins spécifiques en soins de support, et en particulier d’une évaluation nutritionnelle. Ce travail s’inscrit soit dans l’EGA, soit dans le parcours de soins, ou bien encore pendant ces deux temps. Le référentiel organisationnel national « Soins oncologiques de support des patients adultes atteints de cancer » propose des grilles de repérage et d’évaluation des besoins en soins de support destinés aux patients et aux professionnels de santé. L’utilisation de ces grilles permet de repérer, d’anticiper et d’identifier les points de vigilance pour éviter une perte de chance aux patients (Fig. 1) [26].
Ces grilles se composent :
• d’une grille de repérage de 1er niveau à remplir par le patient (via un auto-questionnaire) ou par un professionnel de santé ou toute personne formée aux soins de support et intervenant auprès du patient. Les modalités de transmission de l’auto-questionnaire doivent lui être indiquées (remise lors d’une prochaine consultation, envoi postal, envoi par mail, etc.) ;
• de questions de repérage de 2e niveau. À la suite de l’analyse de la grille de repérage de 1er niveau, des questions de repérage des besoins de 2e niveau peuvent être soumises au patient par un professionnel de santé ou, en fonction des besoins en soins de support identifiés, une orientation directe vers des professionnels de soins de support peut être proposée et effectuée.
Dans ces questionnaires, l’état nutritionnel est évalué par :
• une évaluation simplifiée et validée des apports alimentaires,
• de la variation pondérale (perte ou prise de poids),
• des difficultés à s’alimenter (dysphagie, odynophagie, troubles de la déglutition, nausées, vomissements)
• et de potentiels régimes restrictifs menés dans le cadre de pathologies chroniques (diabète de type II, maladies cardiovasculaires, insuffisance rénale par exemple).
L’état nutritionnel : diagnostic et prise en soins
Chez les personnes âgées de 70 ans et plus ayant un cancer, l’évaluation de l’état nutritionnel se traduit par la recherche de carences en micronutriments telles que les hypovitaminoses (vitamines D, B9, B12 par exemple), les carences en minéraux et oligo-éléments (phosphore, magnésium, fer, zinc, sélénium, etc.), et les carences en macronutriments pouvant aboutir à une situation pathologique : la dénutrition protéino-énergétique.
Dénutrition protéino-énergétique
La dénutrition protéino-énergétique se définit comme un état de déséquilibre nutritionnel caractérisé par un bilan énergétique et/ou protéique négatif. La dénutrition peut être liée à un ou plusieurs des facteurs suivants :
• un déficit d’apport protéino-énergétique,
• une augmentation des dépenses énergétiques totales,
• une augmentation des pertes énergétiques et/ou protéiques [27].
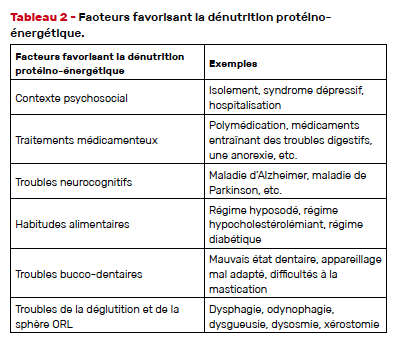
En plus de ces causes, d’autres facteurs sont impliqués dans la survenue d’une dénutrition chez un sujet âgé (Tab. 2).
La dénutrition est une caractéristique fréquente des patients atteints de cancer. Elle est la conséquence à la fois de la présence de la tumeur et des traitements anticancéreux médicaux et chirurgicaux. Le déséquilibre inhérent à la dénutrition conduit à des effets délétères sur les tissus avec des changements mesurables des fonctions corporelles et/ou de la composition corporelle. C’est ce qui explique qu’elle apparaît chez la personne âgée comme un facteur pronostique défavorable qu’elle soit porteuse de cancer ou non [28]. Elle diminue la qualité de vie et augmente le risque de dépendance. Il s’installe alors une spirale délétère entre les causes et les conséquences de la dénutrition. Ainsi, il est montré depuis plusieurs années que la dénutrition est un facteur de risque indépendant de décès pour des patients âgés recevant une chimiothérapie [29, 30]. L’absence d’identification systématique, et donc de prise en charge de la dénutrition, entraîne également une augmentation des coûts, près de 40% des sujets âgés sont hospitalisés pour des conséquences d’une dénutrition [31, 32]. La dénutrition constitue donc une charge financière majeure pour les collectivités. Cette charge ne pourra que croître avec le vieillissement de la population.
Dépistage et diagnostic
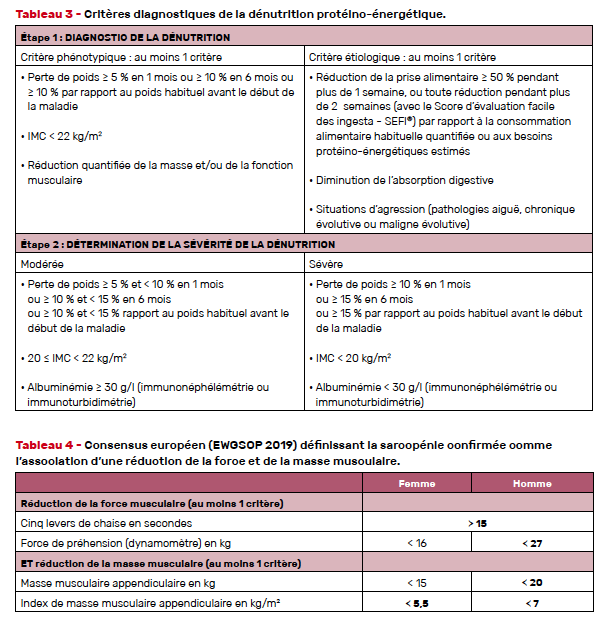
Le dépistage et le diagnostic reposent sur des critères ayant fait l’objet d’une révision méthodique par la Haute Autorité de santé en 2021 [28] (Tab. 3). Le questionnaire MNA (Mini nutritionnal assessment), qui a inspiré le test G8, ne constitue plus un critère diagnostique de dénutrition.
Le dépistage repose désormais sur l’identification d’un critère étiologique et d’un critère phénotypique. À ce niveau les données paracliniques comme l’albumine ne sont pas utiles. Le seuil acceptable de l’IMC est majoré à 22 kg/m2 au lieu de 21. La principale difficulté pour les cliniciens sera d’évaluer la sarcopénie en lieu et place d’une évaluation du poids et de la taille pour déterminer l’IMC (quand le patient n’est pas mobilisable) pour identifier un critère phénotypique. En effet, l’évaluation de la sarcopénie demande des moyens peu accessibles dans la pratique courante (Tab. 4). Si la réduction de la force musculaire est objectivable par un dynamomètre (facile à réaliser), évaluer la masse musculaire demande au contraire des moyens techniques contraignants et coûteux : absorptiométrie biphotonique (DEXA) et impédancemétrie.
Aussi, il faut rappeler que les personnes âgées en situation d’obésité (IMC ≥ 30) peuvent être dénutries. Les critères de dénutrition sont les mêmes que chez les personnes âgées non en situation d’obésité, à l’exception de l’IMC qui ne constitue pas dans ce cas un critère. Il est déconseillé d’induire volontairement une perte de poids chez ces personnes en raison des risques de dénutrition, de sarcopénie et d’incidence sur le pronostic de la maladie.
Le degré de dénutrition, modérée ou sévère, est déterminé dans un second temps et repose sur des critères cliniques et biologiques : cinétique de perte de poids ou IMC ou hypoalbuminémie. La valeur pronostique de l’albumine ne dépend pas de l’existence d’un syndrome inflammatoire concomitant.
Prise en charge de la dénutrition
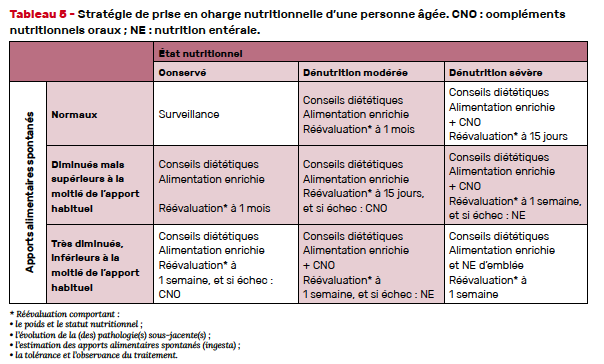
Les modalités de prise en charge sont exposées dans un document de la HAS datant de 2007, mais restent cependant actuelles [33]. Il existe trois niveaux de prise en charge (Tab. 5) :
• L’optimisation des apports oraux spontanés (par le fractionnement des prises alimentaires, l’augmentation des apports protéiques et glucido-lipidiques) ;
• la prescription de compléments nutritionnels oraux (CNO). Ils relèvent des DADFMS (denrées alimentaires destinées à des fins médicales spéciales) et non de la classe des médicaments. Ils sont remboursés sur prescription médicale. Un arrêté ministériel fixe les conditions de prescription et de renouvellement et indique que pour les personnes âgées, sauf exceptions, l’objectif est d’atteindre un apport alimentaire supplémentaire de 400 kcal par jour et/ou de 30 g de protéines par jour [34]. La première prescription est effectuée pour un mois maximum et la première délivrance est limitée à 10 jours de traitement. Les CNO se présentent sous différentes formes (potages, biscuits, crèmes, boissons lactées ou à base de jus de fruits) et avec une variété de goûts et de saveurs (sucrés, salés). Pour garantir une efficacité optimale, la prescription devra tenir compte des préférences et des goûts ;
• l’assistance nutritionnelle artificielle (entérale ou parentérale). Le recours à cette technique peut être nécessaire si les apports nutritionnels restent insuffisants malgré une alimentation orale enrichie, si l’alimentation orale est impossible, si certains traitements auront pour effet indésirable prévisible une grande difficulté ou une impossibilité à maintenir des apports per os. Dans tous les cas, son usage devra faire l’objet d’une réflexion pour en évaluer la faisabilité et la pertinence. Une réflexion éthique est recommandée dans les situations palliatives afin de considérer avec le patient le pronostic de la maladie, le bénéfice attendu sur la qualité de la vie et potentiellement la survie, ainsi que les inconvénients de cette technique (passages infirmiers, sonde, mobilité, etc.) [9, 35].
Conclusion
La nutrition est une spécialité à part dans le programme personnalisé de soins de la personne âgée atteinte de cancer. À la croisée de la médecine et des soins oncologiques de support, elle est incontournable dans la prise en charge globale et multidisciplinaire du patient : sur le plan médical, elle améliore la survie et diminue la toxicité des traitements, et sur le plan des soins de support, elle améliore la qualité de vie des malades et de leurs proches.
Dans nos organisations de soins, en ville comme à l’hôpital, demeure l’enjeu de prévenir, de diagnostiquer et de traiter la dénutrition protéino-énergétique. Pour ce faire, l’outil G8 permet d’identifier les patients pour qui une évaluation gériatrique approfondie est requise. Cette évaluation multimodale permettra de définir et de graduer le programme personnalisé de soins en mettant en œuvre les soins de support appropriés, dont la prise en charge nutritionnelle. Au cœur de ce parcours de soins, les professionnels de santé que sont les diététiciens nutritionnistes sont des alliés précieux sur lesquels les équipes médico-soignantes peuvent s’appuyer.
Les auteurs déclarent n’avoir aucun conflit d’intérêt en rapport avec cet article.
Bibliographie
1. Defossez G, Le Guyader-Peyrou S, Uhry Z et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Tumeurs solides, Volume 1. Saint-Maurice : Santé Publique France 2019. p. 337.
2. Rowland JH, Bellizzi KM. Cancer survivors and survivorship research: a reflection on today’s successes and tomorrow’s challenges. Hematol Oncol Clin North Am 2008 ; 22 :181–200.
3. Bluethmann S, Mariotto A, Rowland. Anticipating the «Silver Tsunami»: Prevalence Trajectories and Comorbidity Burden among Older Cancer Survivors in the United States. Cancer Epidemiology Biomarkers & Prevention 2016 ; 25 : 1029-36.
4. Masse M, Meire P. Is ageism a relevant concept for health care practice in the elderly? Geriatr Psychol Neuropsychiatr Viellissement 2012 ; 10 : 333–41.
5. Bagegni NA, Peterson LL. Age-related disparitiesin older women with breast cancer [en ligne]. In: Advances in cancer research. Elsevier 2020 : 23-56.
6. Loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé.
7. INCa. Le nouveau programme personnalisé de soins / Référentiel organisationnel. INCa 2019.
8. Bourdel-Marchasson I, Guérin O. Nutrition chez le patient adulte atteint de cancer : stratégie thérapeutique en cas de dénutrition du sujet âgé. Nutrition clinique et métabolisme 2012 ; 26 : 296-302.
9. Muscaritoli M, Arends J, Bachmann P et al. ESPEN practical guideline: Clinical Nutrition in cancer. Clinical Nutrition 2021 ; 40 : 2898-913.
10. Lannering C, Ernsth Bravell M, Midlöv P et al. Factors related to falls, weight-loss and pressure ulcers–more insight in risk assessment among nursing home residents. J Clin Nurs 2016 ; 25 : 940-50.
11. Muurinen S, Savikko N, Soini H et al. Nutrition and psychological well-being among long-term care residents with dementia. J Nutr Health Aging 2015 ; 19 : 178-82.
12. Pezzana A, Cereda E, Avagnina P et al. Nutritional Care Needs in Elderly Residents of Long-Term Care Institutions: Potential Implications for Policies. J Nutr Health Aging 2015 ; 19 : 947-54.
13. Mohile SG, Fan L, Reeve E et al. Association of cancer with geriatric syndromes in older medicare beneficiaries. J Clin Oncol 2011 ; 29 : 1458-64.
14. Inouye SK, Studenski S, Tinetti ME, Kuchel GA. Geriatric syndromes: clinical, research, nd policy implications of a core geriatric concept. J Am Geriatr Soc 2007 ; 55 : 780-91.
15. Wildiers H, Heeren P, Puts M et al. International Society of Geriatric Oncology consensus on geriatric assessment in older patients with cancer. J Clin Oncol 2014 ; 32 : 2595-603.
16. Hamaker ME, Wildes TM, Rostoft S. Time to stop saying geriatric assessment is too time consuming. J Clin Oncol 2017 ; 35 : 2871–4.
17. Ferrat E, Paillaud E, Laurent M et al. Predictors of 1- year mortality in a prospective cohort of elderly patients with cancer. J Gerontol A Biol Sci Med Sci 2015 ; 70 : 1148-55.
18. Ørum M, Jensen K, Gregersen M et al. Impact of comprehensive geriatric assessment on short-term mortality in older patients with cancer: a follow-up study. Eur J Cancer 2019 ; 116 : 27-34.
19. Kumar Pal S, Katheria V, Hurria A. Evaluating the older patient with cancer: understanding frailty and the geriatric assessment. CA Cancer J Clin 2010 ; 60 : 120-32.
20. Caillet P, Canoui-Poitrine F, Vouriot J et al. Comprehensive geriatric assessment in the decision-making process in elderly patients with cancer: ELCAPA study. J Clin Oncol 2011 ; 29 : 3636-42.
21. Soubeyran P, Bellera C, Goyard J et al. Screening for vulnerability in older cancer patients: the ONCODAGE prospective multicenter cohort study. PloS One 2014 ; 9 : e115060.
22. Saliba D, Elliott M, Rubenstein LZ et al. The vulnerable elders survey: a tool for identifying vulnerable older people in the community. J Am Geriatr Soc 2001 ; 49 : 1691-9.
23. Belmin J, Khellaf L, Pariel S et al. Validation of the French version of the Vulnerable Elders Survey-13 (VES-13). BMC Med Res Methodol 2020 ; 20 : 21.
24. Circulaire DHOS/SDO/2001/101 du 22 février 2005 relative à l’organisation des soins en cancérologie.
25. Instruction DGOS/R3/INCa/2017/62 du 23 février 2017 relative à l’amélioration de l’accès aux soins de support des patients atteints de cancer.
26. INCa. Soins oncologiques de support des patients adultes atteints de cancer / Référentiel organisationnel national / avis d’experts. INCa 2021.
27. HAS-FFN. Diagnostic de la dénutrition chez la personne de 70 ans et plus, Recommander les bonnes pratiques. HAS-FFN 2021.
28. Wallace J, Schwartz R, Lacroix A. Involuntary weight loss in older outpatients: incidence and clinical significance, J Am Geriat Soc 1995 ; 43 : 329-37.
29. Pentheroudakis G, Fountzilas G, Kalofonos HP, Hellenic Cooperative Oncology Group. Palliative chemotherapy in elderly patients with common metastatic malignancies: a Hellenic cooperative oncology group registry analysis of management, outcome and clinical benefit predictors, Crit Rev Oncol Hematol 2008 ; 66 : 237-47.
30. Aaldriks AA, Maartense E, le Cessie S et al., Predictive value of geriatric assessment for patients older than 70 years, treated with chemotherapy, Crit Rev Oncol Hematol 2010 ; 79 : 212-5.
31. Seguy D, Hubert H, Robert J et al. Compliance to oral nutritional supplementation decreases the risk of hospitalisation in malnourishedolder adults without extra health care cost: Prospective observational cohort study. Clinical Nutrition 2020 ; 39 : 1900-7.
32. Mowé M, Bøhmer T, Kindt E. Reduced nutritional status in an elderly population (> 70 y) is probable before disease and possibly contributes to the development of disease. Am J Clin Nutr 1994 ; 59 : 317-24.
33. HAS. Stratégie de prise en charge en cas de dénutrition protéino-énergétique chez la personne âgée, Recommandations professionnelles. HAS 2007.
34. Arrêté du 7 mai 2019 portant modification de la procédure d’inscription et des conditions de prise en charge des produits pour complémentation nutritionnelle orale destinés aux adultes inscrits sur la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale. Disponible sur : www.legifrance.gouv.fr/eli/arrete/2019/5/7/SSAS1913497A/jo/texte.
35. Grodard-Humbert G, Aubry R. Nutrition artificielle chez les patients cancéreux en fin de vie : les clés d’une démarche éthique, Médecine palliative 2021 ; 20 : 250-9.